GloMax Galaxy: Nová éra bioluminiscenčního zobrazování v proteinové biologii
Zobrazování buněk pomocí fluorescenční mikroskopie je už léta využívanou technikou, pomocí které lze studovat rozličné buněčné děje a struktury. Analýza slabě zastoupených proteinů v živých buňkách je nicméně náročná kvůli faktorům, jako je autofluorescence proteinů, vysoké pozadí a fototoxicita excitačního záření při delších expozicích. U bioluminiscence je tok fotonů ze vzorku výrazně nižší než u fluorescence a je tedy nutné použít výrazně delší expoziční časy v řádu sekund až minut. Nicméně díky absenci excitačního záření nedochází k žádným interferencím z rozptýleného světla a nedochází k autofluoresci ani autoluminiscenci a zobrazování tak má minimální pozadí umožňující i zobrazení velmi málo zastoupených proteinů.
Vizualizujte NanoLuciferázové reportéry pomocí GloMax Galaxy
Až donedávna bylo bioluminiscenční zobrazování spíše okrajovou metodou zejména proto, že světluškové a Renilla luciferázy mají relativně slabý signál a i na nákladných mikroskopech s velmi citlivými a drahými EM-CCD kamerami vyžadují dlouhé expoziční časy. Problém s intenzitou bioluminiscence se podařilo vyřešit společnosti Promega pomocí jejich patentované NanoLuc luciferázy, která má zhruba 150x intenzivnější signál než ostatní luciferázy. Kromě standardních reportérových esejí lze velmi efektivně využít i její rozdělené varianty NanoBiT a HiBiT, které pak umožňují sledovat rozličné aspekty proteinové biologie od proteinových interakcí, syntézy a degradace proteinů, přes internalizaci a cyklování membránových proteinů až po zabíjení rakovinných buněk. Bližší informace si můžete přečíst v našem článku ZDE.
Druhý problém nákladné instrumentace nyní Promega řeší svým novým přístrojem pro bioluminiscenční zobrazování, GloMax Galaxy, který byl navržen jako cenově dostupná varianta. Ten umožňuje vizualizaci bioluminiscenčních reportérů na bázi NanoLuc luciferázy (ale i jiných luciferáz), v kombinaci s fluorescencí (NanoBRET eseje) a brightfieldem. Přístroj disponuje jedním objektivem 20X objektivem a citlivým 7Mpx CMOS detektorem chlazeným na -25°C pro maximální citlivost a minimální šum. Aby byl přístroj cenově co nejdostupnější, nákladné lasery pro excitaci fluorescence byly nahrazeny intenzivními LED moduly s úzkým pásem excitačního záření a místo dichroických zrcadel běžných u klasických mikroskopů je přístroj vybaven sadou optických filtrů pro běžně používané fluorofory, jako je GFP, mCherry, Cy5 nebo Janelia Fluor® barviva. GloMaxy Galaxy je také možné vybavit inkubační komorou a provádět i time-lapse zobrazování v reálném čase. V jednoduchém intuitivním softwaru pak snadno nastavíte jednotlivé parametry snímání.
A jaké jsou vlastně aplikace? Jak už bylo zmíněno, NanoLuc poskytuje širokou paletu nástrojů pro sledování proteinové biologie. Mezí hlavní aplikace patří zejména:
- Sledování genové exprese pomocí klasických luciferázových esejí s využitím NanoLuc luciferázy
- Sledování produkce, degradace nebo sekrece proteinů pomocí proteinové značky HiBiT
- Lokalizace a translokace proteinů v rámci buněk
- Sledování proteinových interakcí pomocí technologie NanoBiT PPI
- Sledování interakcí proteinů a proteinů a malých molekul pomocí NanoBRET technologie kombinující NanoLuc luciferázu se specifickými fluorofory
- Sledování nástupu apoptózy pomocí RealTime-Glo Annexin V eseje od Promegy
- Monitoring zabíjení rakovinných buněk pomocí HiBiT
Níže si pak můžete prohlédnout data z ukázkových experimentů.
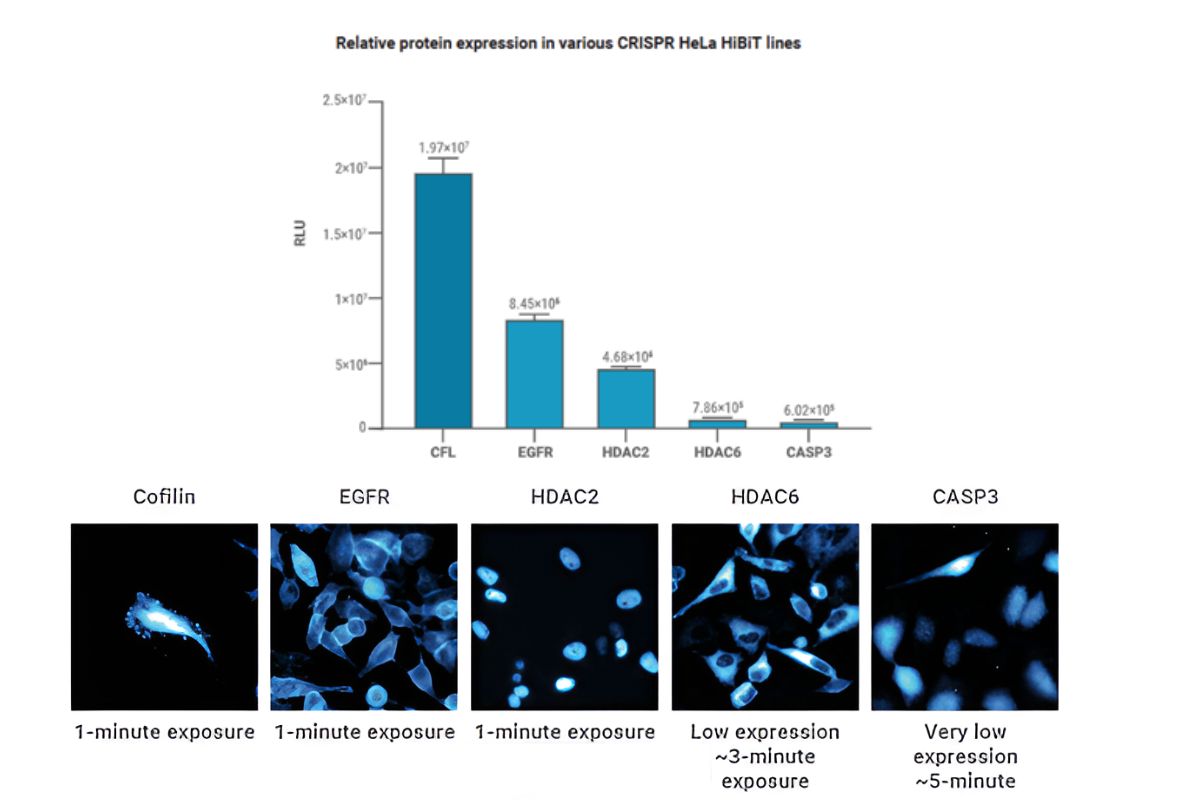
Sledování málo zastoupených proteinů pomocí bioluminiscence
V tomto experimentu vytvořila Promega několik stabilních HeLa linií, kde byly jednotlivé proteiny značeny pomocí HiBiT značky v endogenním lokusu pomocí CRISPR/Cas9 technologie. Na obrázku pak vidíte porovnání dat z mikrodestičkového readeru a příslušné snímky identických vzorků z GloMaxu Galaxy. Jak vidíte, i málo zastoupené proteiny jako je histondeacetyláza 6 nebo kaspáza-3 za neapoptotických podmínek lze pomocí bioluminiscence zobrazit s minimálním pozadím.
Sledování proteinové kinetiky v čase
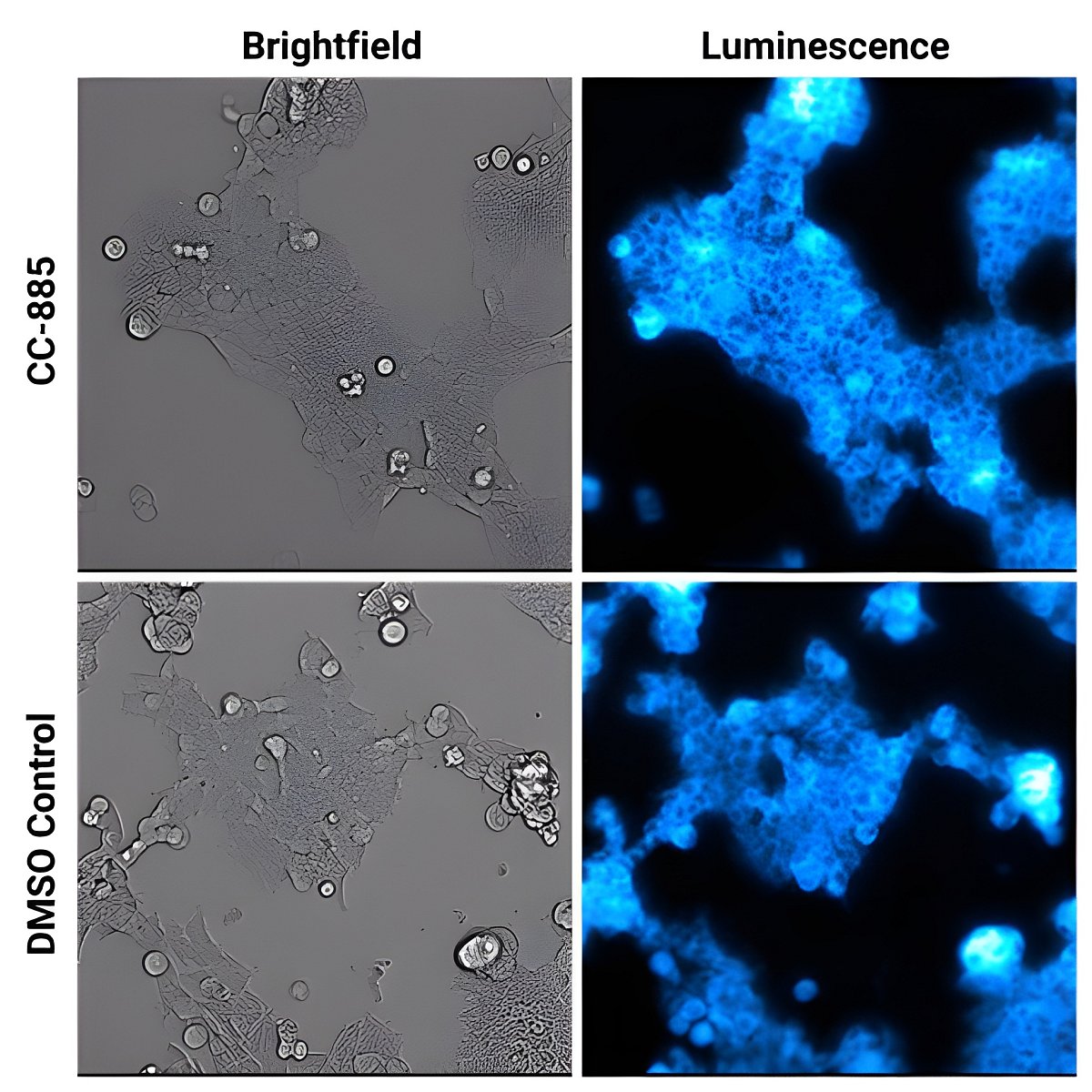
Hlavním přínosem bioluminiscenčního zobrazování je stabilita a udržitelnost bioluminiscenčního signálu, který nevyžaduje žádné excitační záření. Díky tomu nedochází fototoxickému působení záření ani k photobleachingu barviv, které jsou běžné ve fluorescenci a mohou ovlivňovat viabilitu a stabilitu signálu v čase. Bioluminiscenční značky umožňují opakované měření po dobu dní, týdnů nebo měsíců, aniž by docházelo k ovlivňování fyziologie studovaných buněk. Lze také snáze sledovat i jemné změny v intenzitě signálu díky nižšímu toku fotonů ze vzorku, což činí bioluminiscenci optimální např. pro sledování cílené degradace proteinů pomocí PROTAC molekul.
Cílená degradace proteinů v čase - HEK293 buňky exprimující endogenně značený GSPT1 pomocí HiBiT značky a stabilně exprimující LgBiT byly treatovány pomocí CC-885 molekuly cílící na GSPT1 nebo pomocí DMSO jako kontroly. Následně byl přidán Nano-Glo Vivazine Live Cell Substrate a buňky byly zobrazovány po dobu 5 hodin na přístroj GloMax Galaxy vybaveném inkubační komorou. Průběh experimentu naleznete ZDE.
Měření interakcí malých molekul s proteiny
GloMax Galaxy také umožňuje vizualizaci NanoBRET technologie, kterou lze využít pro sledování proteinových interakcí nebo sledování vazby malých molekul. V případě proteinových interakcí se jeden protein označí celou NanoLuc (donor) luciferázou a druhý protein proteinovou značkou HaloTag společně s fluorescenčním ligandem (akceptor). Pokud značené proteiny interagují, přitáhnou donor i akceptor k sobě, dojde k přenosu energie na fluorofor a můžeme detekovat nárůst fluorescenčního signálu akceptoru.
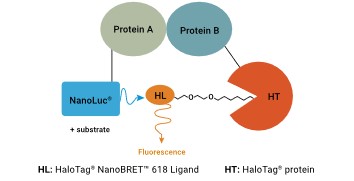
Princip sledování proteinových interakcí pomocí NanoBRET technologie
Kromě toho lze NanoBRET využít i pro tzv. „target engagement“ eseje v živých buňkách, kdy můžeme sledovat přechod malých molekul přes membránu a vazbu do aktivního místa enzymu (např. kinázových inhibitorů). V tomto případě se enzym, jehož aktivitu chceme inhibovat naznačí NanoLuc luciferázou (donor) a jako akceptor slouží permeabilní fluorescenční tracer, což je malá molekula, která se váže do aktivního místa enzymu, a je konjugovaná s fluoroforem. Za standardních podmínek tedy dochází k energetickému přenosu na fluorescenční tracer. Po přidání testované látky dochází k vytěsnění traceru z aktivního místa a poklesu signálu akceptoru. Z měření lze pak určit sílu vazby testované látky do aktivního místa a také jak dlouho zůstává na enzym vázaná (tzv. residence time).
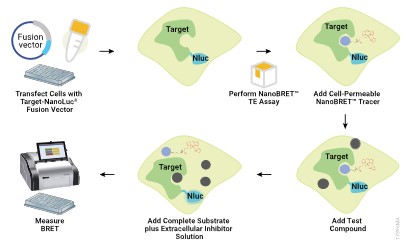
Princip měření vazby nových látek na cílový protein pomocí NanoBRET TE technologie.
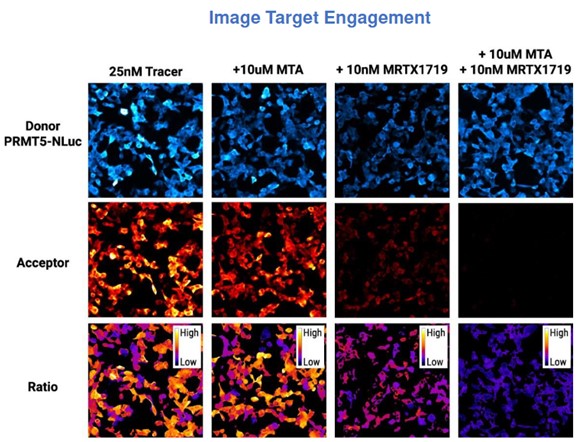
Příklad vizualizace NanoBRET TE experimentu. Buňky HEK293 byly transfekovány NanoLuc-PRMT5 a treatovány samotným NanoBRET tracerem nebo rozdílnými koncetracemi inhibitoru PRMT5 po dobu 3 hodin. Při použití kombinace MTA a MRTX1719 dochází k synergistickému vytěsnění traceru a redukci BRET signálu.
Pokud Vás přístroj GloMax Galaxy zaujal a chtěli byste znát detailnější informace o přístroji nebo máte jakékoliv dotazy, neváhejte nás kontaktovat a rádi Vám poskytneme další informace o přístroji, případně domluvíme virtuální demo s dodavatelem.
 |
Autor článku: Ing. Vojtěch Ledvina, Ph.D aplikační a produktový specialista molekulární biologie, buněčná biologie, proteomika, spotřební materiál email: vojtech.ledvina@eastport.cz, tel.: 725 320 796 |