Sledujte viabilitu a cytotoxicitu s buněčnými esejemi Promega
Sledování viability buněk, nástupu apoptózy nebo cytotoxického účinku látek je nedílnou součástí mnoha odvětví biologického a klinického výzkumu. Nabídky esejí pro tento účel je ale poměrně široká a tak jsme si pro vás připravili přehledový článek, který vám pomůže se v této problematice lépe zorientovat.
Eseje pro sledování zdraví buněk
Sledování viability buněk, nástupu apoptózy nebo cytotoxického účinku látek je nedílnou součástí mnoha odvětví biologického a klinického výzkumu. Ať už se zabýváte testováním účinku toxických látek nebo polutantů z prostředí, vývojem léčiv, imunoterapií nebo např. vlivem knockoutu genů na životaschopnost buněk, testování výše zmíněných parametrů je vaším denním chlebem. V naší nabídce najdete velké množství kitů od americké společnosti Promega určených pro tyto účely a může být obtížné se v nich vyznat. Proto jsme pro Vás připravili tento přehledový článek, kde vypíchneme ty nejpoužívanější eseje z této kategorie.
Osnova článku:
- Rozdělení esejí na základě typu signálu
- Absorbační eseje
- Fluorescenční eseje
- Luminisceční eseje
- Měření viability buněk
- Měření Cytotoxicity
- Měření nástupu apoptózy
Rozdělení esejí na základě typu signálu
Podle druhu měřeného signálu lze buněčné eseje rozdělit do 3 základních skupin, které se liší svojí citlivostí a cenou, a to sice na:
- Absorbanční
- Fluorescenční
- Luminiscenční
Absorbanční eseje
Absorbanční eseje jsou založené na měření změny barvy barviva, které je metabolizováno buňkami. Absorbanční měření jsou nejméně citlivá ze všech, protože mají velmi vysoké hodnoty pozadí a nízký poměr signál/šum. Zároveň mají malý lineární rozsah a nelze kombinovat více esejí v jednom vzorku. Na druhou stranu jsou ale levná a lze je měřit i na jednoduchém absorbančním mikrodestičkovém readeru. Z toho důvodu jsou často první volbou mnoha laboratoří. Příklady takových esejí jsou např. MTS, WST, XTT aj.
Fluorescenční eseje
Fluorescenční eseje využívají měření změny fluorescenčních vlastností barviva po inkubaci s buňkami. Může docházet ke změně vlnové délky emise nebo zesílení samotné fluorescence vlivem vazby na dsDNA nebo odštěpením zhášeče. Oproti absorbanci mají fluorescenční eseje lepší poměr signál/šum a širší lineární rozsah (4-5 řádů) a při měření lze kombinovat více spektrálně kompatibilních fluoroforů v jednom vzorku, případně měření kombinovat s luminiscencí.
Luminiscenční eseje
Luminiscenční stanovení využívají pro měření luciferázovou reakci, kdy spolu interaguje vždy enzym luciferáza a její substrát luciferin. Substrát může být chemicky modifikovaný tak, že musí být nejprve zpracován testovanou buňkou a až poté je přístupný pro luciferázu. Případně lze přímo využít vlastnost firefly luciferázy, která vyžaduje pro funkci energii z ATP. Pokud odstraníme ATP z detekčního kitu, lze pak velmi jednoduše měřit množství ATP v buňkách. Luminiscenční eseje nevyžadují žádnou excitaci pomocí světla a veškerý signál je generovaný chemicky uvnitř vzorku. Díky tomu mají tyto eseje nejvyšší poměr signál/šum a zároveň i nejširší lineární rozsah až 10 řádů.
Když jsme si nyní probrali výhody a nevýhody jednotlivých detekčních módů, můžeme se blíže podívat na principy stanovení jednotlivých buněčných parametrů.
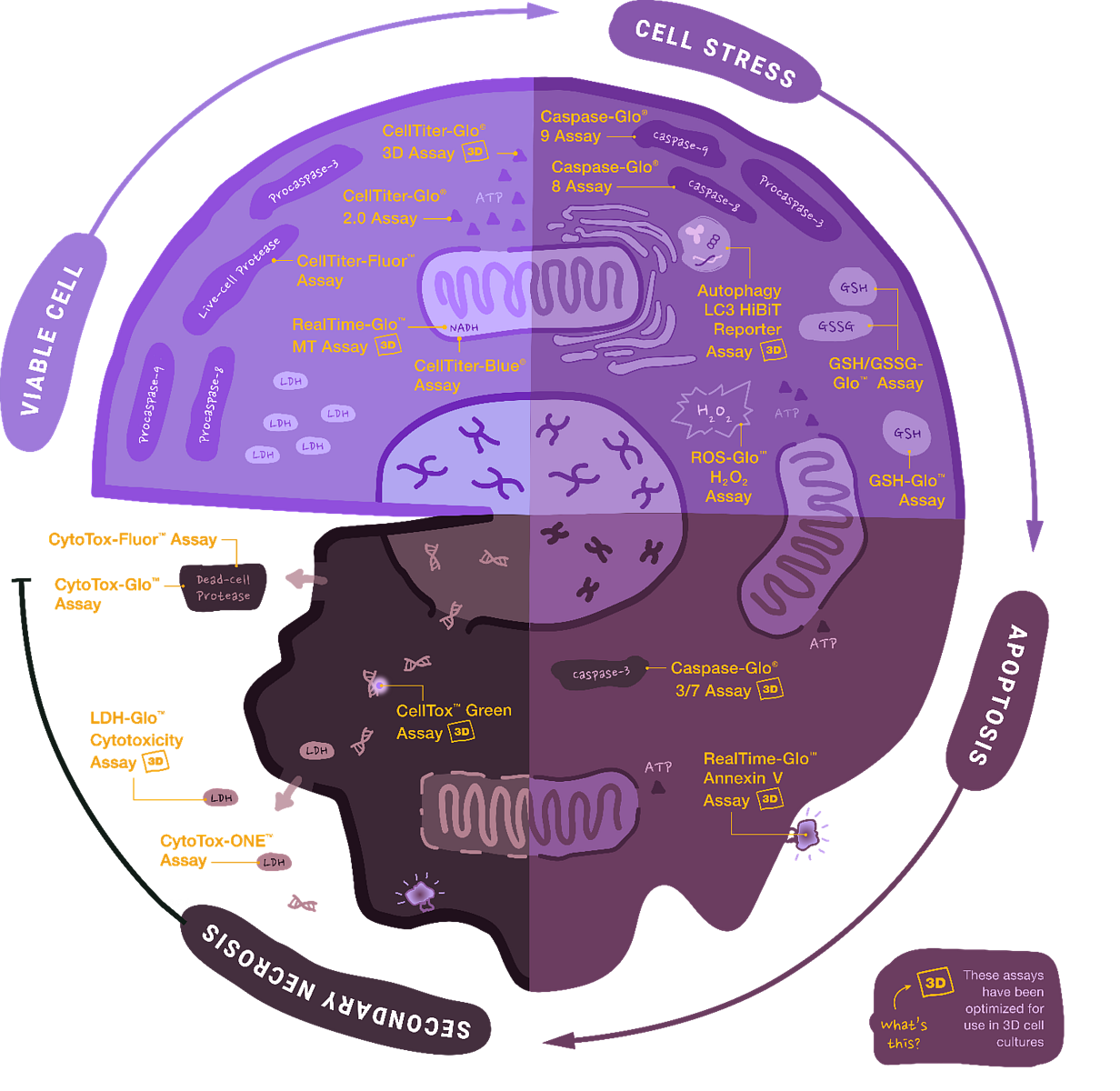 Obr. 1 Přehled buněčných esejí pro sledování viability, cytotoxicity a apoptózy od společnosti Promega
Obr. 1 Přehled buněčných esejí pro sledování viability, cytotoxicity a apoptózy od společnosti Promega
Měření viability buněk
Při měření viability buněk stanovujeme vždy počet živých buněk v kultuře. Za živou a viabilní obecně považujeme buňku, která nemá narušenou cytoplazmatickou membránu, je metabolicky aktivní a aktivně proliferuje. Nejčastěji využívaným markerem pro měření viability jsou redukční ekvivalenty NADH nebo NADPH, které buňka využívá k redukci barviva, dále je to obsah ATP v buňkách a v neposlední řadě i činnost specifických proteáz, které jsou aktivní jen v živých buňkách.
CellTiter 96 Aqueous One Assay (MTS) je kolorimetrická esej využívající redukci MTS barviva na ve vodě rozpustný formazan s odlišným zbarvením a absorbčním maximem. Oproti konkurenčním esejím jako je XTT nebo MTT se jedná o jednokrokové stanovení, kdy stačí detekční barvivo přidat k buňkám a po 1-4 hodinové inkubaci lze rovnou měřit abosrbanci při 490 nm bez nutnosti dodatečného rozpouštěcího kroku. S MTS esejí jste schopni detekovat cca 1000 viabilních buněk v jedné jamce 96-jamkové destičky. Druhou esejí využívající redukční ekvivalenty je CellTiter-Blue Cell Viability Assay, kde dochází k redukci resazurinu na resorufin uvnitř buněk pomocí NAD(P)H. S tím je pak spojená i změna zbarvení. Po 1-4 hodinové inkubaci pak lze měřit absorbanci při 570 nm nebo fluorescenci (560Ex/590Em nm), kdy dosáhnete o něco vyšší citlivosti. Ve fluorescenčním módu lze detekovat asi 400 buněk v jedné jamce.
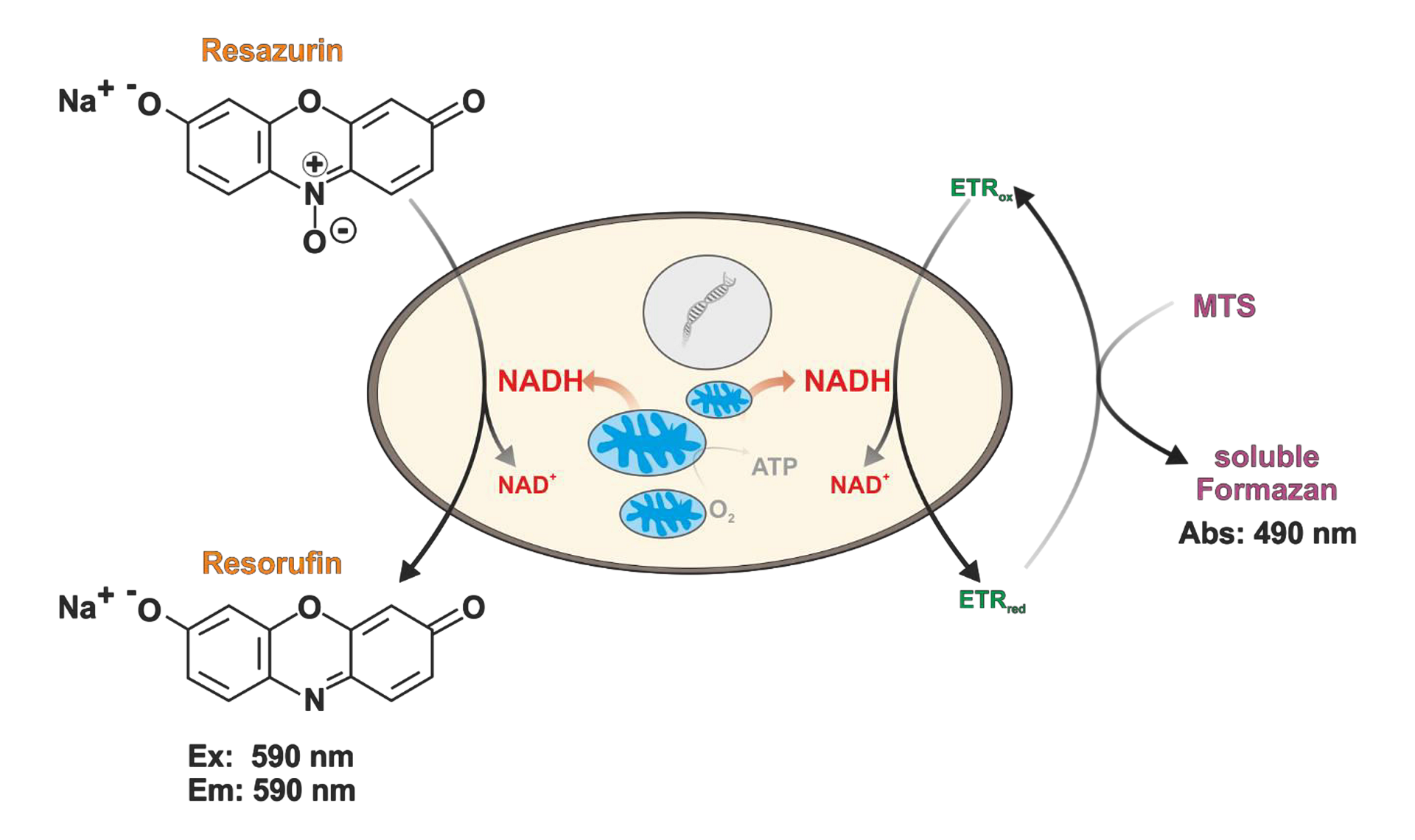 Obr. 2 Princip měření viability pomocí CellTiter-Blue eseje (nalevo) a CellTiter 96 (napravo)
Obr. 2 Princip měření viability pomocí CellTiter-Blue eseje (nalevo) a CellTiter 96 (napravo)
Redukční ekvivalenty využívá i luminiscenční esej RealTime-Glo MT. V tomto případě je součástí detekčního kitu NanoLuc luciferáza a její chemicky modifikovaný permeabilní substrát pro-furimazin. Během stanovení proniká z média do buněk, kde dochází k jeho redukci. Po uvolnění zpět do média je zpracován NanoLuc lufierázou a generuje se bioluminiscenční záření úměrné počtu viabilních buněk (Obr. 3). Díky bioluminiscenčnímu readoutu se jedná o velmi citlivou esej, která je schopna detekovat i méně než 10 buněk, a je kompatibilní s 2D i 3D kulturami. Esej nijak neovlivňuje viabilitu buněk a je možné měřit signál kontinuálně až po dobu 72 hodin. Signál bioluminiscenční reakce také velmi rychle reaguje na změny v kultuře a pokud buňky začnou umírat, během pár minut začne klesat i signál eseje.
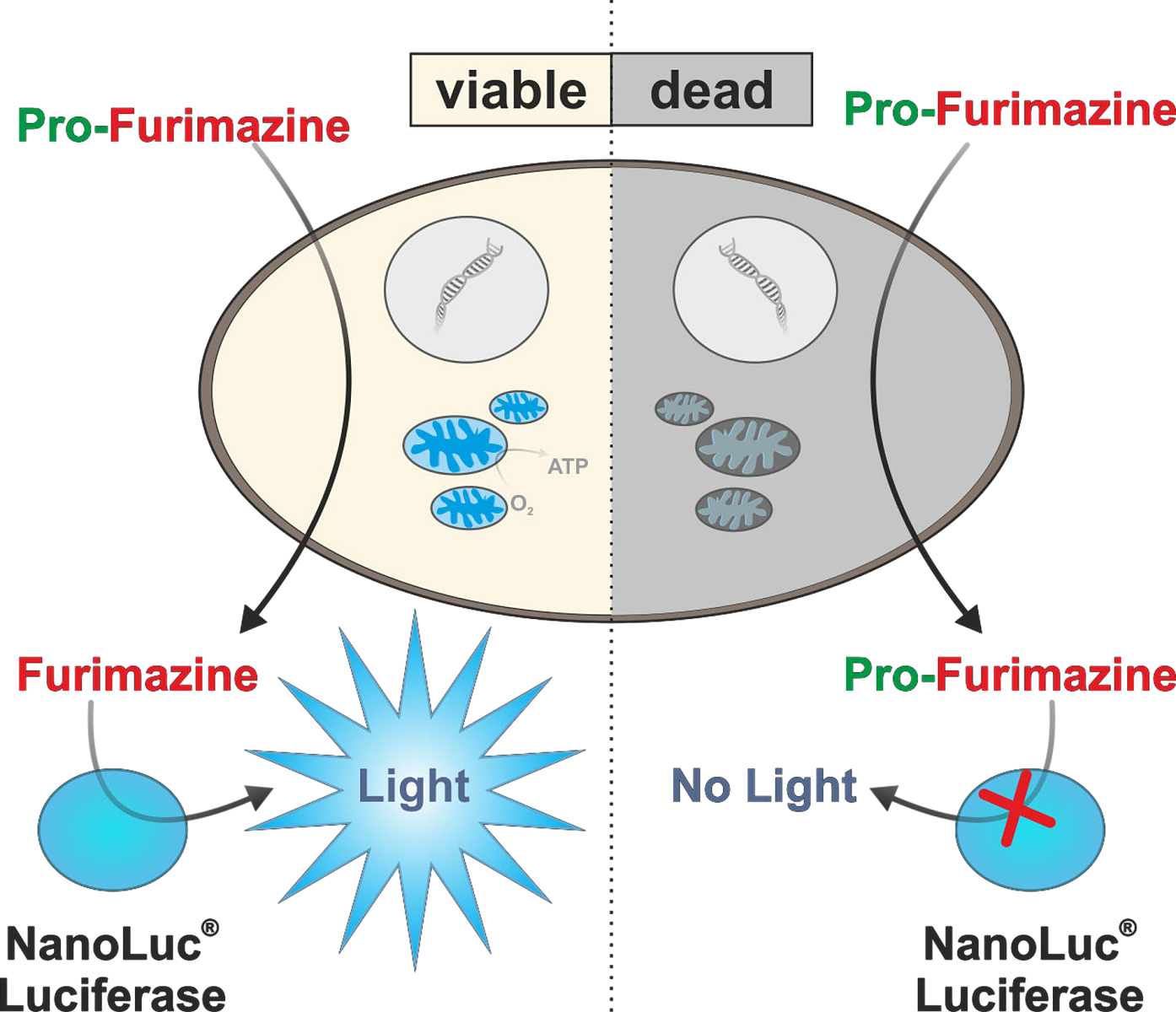 Obr. 3 Princip měření viability pomocí RealTime-Glo MT eseje
Obr. 3 Princip měření viability pomocí RealTime-Glo MT eseje
CellTiter-Fluor je zvláštním typem fluorescenční eseje pro viabilitu, která detekuje činnost specifických proteáz, které jsou aktivní jen v živých buňkách. Kit využívá molekuly aminofluorkumarinu, který je konjugovaný s dipeptidem GF (Gly-Phe), který slouží jako zhášeč fluorescence. Při stanovení difunduje barvivo do buňky, kde je činností specifických proteáz GF dipeptid odštěpen a zesílí se fluorescence kumarinu. Samotné měření pak probíhá při vlnových délkách 380-400Ex/505Em nm a citlivost je asi 40 buněk v 96-jamkové destičce.
Posledním hojně využívaným markerem viability je pak stanovení množství ATP produkovaného buňkami. Na tomto principu je založená esej CellTiter-Glo. Při stanovení dochází k lyzi buněk a uvolnění ATP do roztoku. ATP je pak firefly luciferázou spotřebováno k tvorbě luminiscenčního záření. Citlivost této eseje je velmi vysoká a podobně jako u RealTime-Glo MT lze detekovat i méně než 10 buněk v 96-jamkové destičce. Kit je dostupný v několika variantách. Klasická varianta CellTiter-Glo 2.0 je určena pro 2D kultury a lze ji nově skladovat při 4 °C po dobu několika měsíců. Pro 3D kultury je pak určena varianta CellTiter-Glo 3D, která obsahuje silnější lyzační pufr a mírně modifikovaný protokol stanovení.
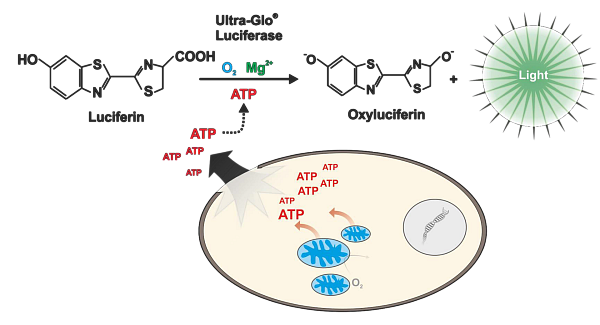 Obr. 3 Měření ATP v buňkách pomocí CellTiter-Glo eseje
Obr. 3 Měření ATP v buňkách pomocí CellTiter-Glo eseje
Uvedené produkty v článku na měření viability buněk
Měření cytotoxicity
Pojmem cytotoxicita označujeme potenciál daného treatmentu poškodit buňky a iniciovat u nich nekrózu nebo jiný druh buněčné smrti. Charakteristickým rysem nekrózy je ztráta integrity cytoplazmatické membrány, což lze využít při detekci pomocí nepermeabilních interkalačních barviv. Dalšími markery jsou uvolňování specifických enzymů, jako je laktát dehydrogenáza, do média nebo aktivace tzv. „dead-cell proteáz“, což jsou proteázy, které se aktivují v buňkách při nekróze.
Pro detekci integrity plazmatické membrány můžete využít barvivo CellTox Green. Jedná se o nepermeabilní interkalační barvivo, které neproniká za normálních podmínek do buněk. Pokud začnou buňky umírat, začnou se v jejich membráně tvořit póry, barvivo pronikne do buňky a váže se na dsDNA (Obr. 4). Při vazbě se skokově zvyšuje intenzita fluorescence a s počtem umírajících buněk narůstá i intenzita fluorescenčního signálu. CellTox Green je navíc buňkami velmi dobře snášen a lze ho použít pro kontinuální sledování toxicity po dobu až 72 hodin. Stačí ho přidat do média a pak měřit. Barvivo lze kromě klasického mikrodestičkového formátu použít i pro průtokovou cytometrii a fluorescenční mikroskopii, protože využívá standardních filtrů pro FITC a GFP.
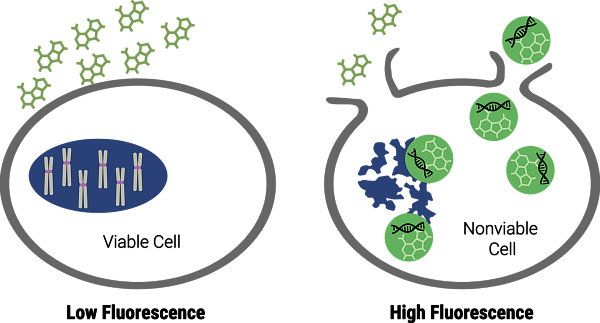 Obr. 4 Princip měření cytotoxicity pomocí CellTox Green eseje
Obr. 4 Princip měření cytotoxicity pomocí CellTox Green eseje
Laktát dehydrogenáza (LDH) je dalším běžně používaným markerem pro sledování cytotoxicity. Pro její detekci lze využít buď fluorescenční nebo luminiscenční esej. V obou případech se při detekci využívá spřažených enzymatických reakcí, kdy v prvním kroku LDH oxiduje laktát na pyruvát a při této reakci se převádí proton pomocí NAD+ kofaktoru na cílovou molekulu. V případě fluorescenční eseje CytoTox ONE se proton použije k redukci resazurinu na resorufin podobně jako u CellTiter Blue eseje a měří se nárůst fluorescence. V případě LDH-Glo se pak redukuje světluškový proluciferin na luciferin a pomocí světluškové luciferázy se generuje bioluminiscenční záření. Hlavní výhodou bioluminiscenční eseje je její vysoká citlivost. Díky tomu, že se LDH uvolňuje do média, lze pro měření odebrat malý alikvot kultivačního média (cca 2-5 µl) do druhé mikrotitrační destičky a z jedné jamky změřit několik časových bodů. Buňky pak lze navíc použít pro další stanovení.
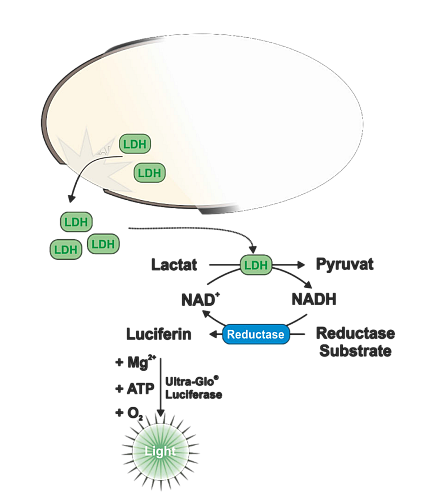 Obr. 5 Princip měření cytotoxicity pomocí LDH-Glo eseje
Obr. 5 Princip měření cytotoxicity pomocí LDH-Glo eseje
Poslední cytotoxickou esejí je CytoTox-Fluor, což je fluorescenční esej detekující aktivitu „dead-cell proteáz“, které se aktivují v umírajících buňkách. Tato esej využívá barvivo rhodamin 110 (R110), které je konjugované s dvěma AAF peptidy, které slouží jako zhášeče fluorescence. Pokud dojde k aktivaci těchto proteáz, odštěpí oba peptidy a zesílí se fluorescence R110. Podobně jako CellTiter-Fluor je i CytoTox-Fluor.
Uvedené produkty v článku měření cytotoxicity
Měření nástupu apoptózy
Apoptóza nebo také programovaná buněčná smrt je typ buněčné smrti, kterým se tělo zbavuje nepotřebných nebo poškozených buněk. Při apoptóze si buňka zachovává vysokou hladinu ATP a integritu cytoplazmatické membrány a rozkládá se organizovaně zevnitř pomocí apoptotického aparátu. Na závěr se buňka rozpadne na tzv. apoptotická tělíska, která jsou fagocytována okolními buňkami, a nedochází k vyvolání zánětlivé odpovědi. Mezi hlavní markery apoptózy patří zejména expozice fosfatidylserinu na vnější stranu plazmatické membrány, aktivace kaspáz, specifických apoptotických proteáz, které zajišťují proteolýzu buněčných proteinů, a fragmentace jaderné DNA.
Fosfatidylserin (PS) je fosfolipid, který je za běžných podmínek otočený do cytoplazmy. Při aktivaci apoptózy dochází k jeho translokaci na vnější stranu plazmatické membrány, kde slouží jako signál pro fagocytózu. Expozici PS lze sledovat v reálném čase pomocí RealTime-Glo Annexin V eseje od Promegy (Obr. 6). Ta je založená na rozdělené NanoLuc luciferáze, jejíž dvě podjednotky jsou konjugovány s molekulami Anexinu V, který se specificky váže na molekuly PS. Při aktivaci apoptózy a otočení PS na vnější stranu membrány dochází k navázání Anexinu V, spojení dvou podjednotek NanoLuc a obnovení luciferázové aktivity. Detekční kit stačí přidat přímo do média a sledovat nárůst signálu v reálném čase. Jedná se tedy o ideální esej pro sledování kinetiky působení neznámých a nově syntetizovaných látek. Esej se prodává i v kombinaci s barvivem CellTox Green a lze tak v jedné jamce sledovat jak nástup apoptózy, tak i případné sekundární nekrózy.
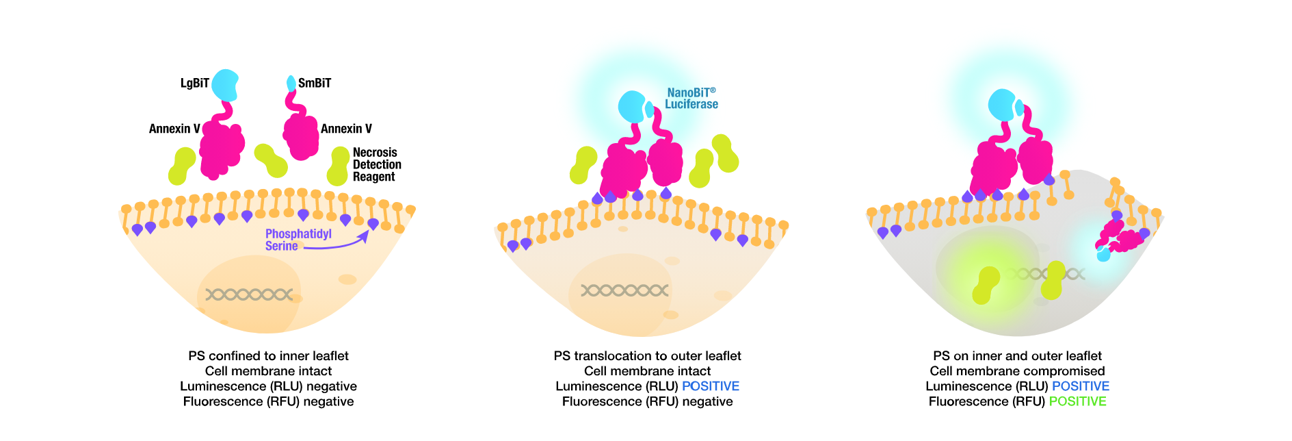 Obr. 6 Detekce PS na vnější straně membrány pomocí RealTime-Glo Annexin V Assay
Obr. 6 Detekce PS na vnější straně membrány pomocí RealTime-Glo Annexin V Assay
Poslední skupinou kitů pro sledování apoptózy jsou Capase-Glo eseje, které detekují proteolytickou aktivitu kaspáz. Kaspázy (cystein dependentní aspartátem řízené proteázy) jsou apoptotické proteázy, které zajišťují aktivaci i samotné provedení apoptózy. V cytoplazmě jsou v podobě neaktivních zymogenů (prokaspáz) a aktivují se oligomerizací a proteolytickým štěpením. Kaspázy se dělí na dvě základní skupiny, tzv. iniciátorové a efektorové. Mezi iniciátorové kaspázy řadíme zejména kaspázu 8 a 9, které se podílejí na aktivaci apoptózy a zajišťují proteolytické štěpení a aktivaci efektorových kaspáz. Kaspáza 8 je součástí vnější apoptotické dráhy, která je spuštěna vazbou ligandů na receptory smrti, jako je např. Fas. Kaspáza 9 je pak součástí vnitřní apoptotické dráhy, která se spouští při vnitřním poškození buňky a je charakteristická uvolňováním cytochromu c z membrány mitochondrií. Mezi nejvýznamnější efektorové kaspázy pak řadíme kaspázy 3, 6 a 7, které po aktivaci štěpí klíčové proteiny v buňce, přičemž kaspáza 3 je z nich nejaktivnější.
Aktivaci kaspázy 3, 8 a 9 lze velmi jednoduše měřit pomocí luminiscenčních esejí Caspase-Glo od Promegy, které využívají firefly luciferázu a modifikovaný substrát aminoluciferin. Ten je substitouván tetrepapetidem, který je specificky štěpen jen danou kaspázou. Po aktivaci kaspázy a oděštěpení tetrapeptidu je volný aminoluciferin oxidován firefly luciferázou a detekuje se bioluminiscenční signál. Pomocí kitu Caspase-Glo 3/7 můžete jednoduše detekovat aktivaci efektorových kaspáz a potvrdit, že u buněk probíhá apoptóza. Kity Caspase-Glo 8 a Caspase-Glo 9 vám pak pomohou snadno rozlišit, kterou apoptotickou dráhu vaše látky indukují.
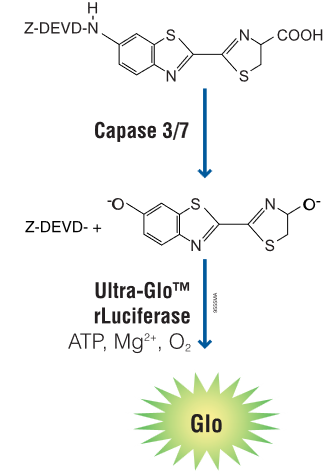
Obr. 7 Princip detekce aktivity kaspázy 3 a 7 pomocí Caspase-Glo eseje
Uvedené produkty v článku měření nástupu apoptózy
Chcete vědět víc?
Zaujaly vás některé ze zmiňovaných esejí a chcete se dozvědět další informace? Nebo byste měli zájem o seminář na míru zaměřený přímo na téma Vašeho výzkumu? Neváhejte nás kontakovat.
 |
Autor článku: Ing. Vojtěch Ledvina, Ph.D aplikační a produktový specialista molekulární biologie, buněčná biologie, proteomika, spotřební materiál email: vojtech.ledvina@eastport.cz, tel.: 725 320 796 |